Перейти к:
Оценка развития легочного русла и результатов двухэтапной коррекции у младенцев с критической формой Тетрады Фалло
https://doi.org/10.38109/2225-1685-2023-4-6-15
Аннотация
Цель: оценить развитие легочного русла и результаты радикальной коррекции после паллиативного лечения у младенцев с критической формой тетрады Фалло.
Материалы и методы. В проспективное рандомизированное двуцентровое исследование включены младенцы с тетрадой Фалло, оперированные в период с 2019 по 2022 гг.: которым выполнялось стентирование выходного отдела правого желудочка (группа «стент», n=21) или формирование модифицированного шунта по Блэлок-Тауссиг (группа «шунт», n=21).
Результаты. В группе стент отмечен более значимый прирост индекса Nakata в среднем с 104,2 до 208,6 мм2/м2, в то время как в группе шунт – с 107,3 до 169,4 мм2/м2 (p<0,01). По результатам смешанной модели скорость роста правой легочной артерии в группе стент 2,05*10-2 z score/день, что в 3,01 раз больше, чем в группе шунт. Скорость роста левой легочной артерии в группе стент 2,3*10-2 z score/день, что в 1,47 раз больше, чем в группе шунт. В группе стент в межэтапном периоде 1 летальный исход, обусловленный некардиальной патологией. При радикальной коррекции у 12 (60%) пациентов в группе стент и у 15 (71,4%) – в группе шунт выполнена трансаннулярная пластика пути оттока в легочную артерию (p=0,52). В оставшихся 8 (40%) случаях группы стент и 6 (28,6%) группы шунт выполнено протезирование легочной артерии. При межгрупповом сравнении длительность операции радикальной коррекции в группе стент достоверно короче (p=0,046), в то время как время окклюзии аорты (p<0,01) и искусственного кровообращения (p<0,01) достоверно меньше в группе шунт.
Выводы. Стентирование выходного отдела правого желудочка обеспечивает стабилизацию гемодинамики и равномерный рост легочного русла в сравнении с формированием модифицированного шунта Блэлок-Тауссиг.
Ключевые слова
Для цитирования:
Морсина М.Г., Сойнов И.А., Войтов А.В., Пурсанов М.Г., Кулябин Ю.Ю., Ничай Н.Р., Горбатых А.В., Архипов А.Н., Богачев-Прокофьев А.В., Чернявский А.М. Оценка развития легочного русла и результатов двухэтапной коррекции у младенцев с критической формой Тетрады Фалло. Евразийский Кардиологический Журнал. 2023;(4):6-15. https://doi.org/10.38109/2225-1685-2023-4-6-15
For citation:
Morsina M.G., Soynov I.A., Voitov A.V., Pursanov M.G., Kulyabin Yu.Yu., Nichay N.R., Gorbatykh A.V., Arkhipov A.N., Bogachev-Prokofiev A.V., Chernyavskiy A.M. Assessment of the pulmonary arterial growth and results of two-stage repair in infants with severe form of tetralogy of Fallot. Eurasian heart journal. 2023;(4):6-15. (In Russ.) https://doi.org/10.38109/2225-1685-2023-4-6-15
Введение
Для симптомных младенцев с тетрадой Фалло и низкой массой тела, с сопутствующей патологией наиболее предпочтительным является этапный подход лечения, при котором вначале выполняется паллиативная операция и спустя время отсроченная анатомическая коррекция [1,2]. Однако наиболее значимыми факторами риска для развития неблагоприятных событий, как при одномоментном выполнении анатомической коррекции, так и для формирования модифицированного шунта Блэлок-Тауссиг (мБТШ) являются низкий вес и выраженная гипоплазия легочного русла [1], [3], [8], [25]. В многочисленных исследованиях, у пациентов с синдромом гипоплазии левых отделов сердца, с атрезией легочной артерии и дефектом межжелудочковой перегородки (тип A, B по Tchervenkov) выявлено, что реконструкция выходного отдела правого желудочка приводит к более эффективной реабилитации легочного русла в сравнении с формированием шунта Блэлок-Тауссиг [9-16]. Таким образом, можно предположить, что устранение выраженной обструкции выходного отдела правого желудочка при тетраде Фалло может привести к более эффективному росту центрального легочного русла в сравнении с мБТШ. За последние годы в литературе встречается все больше работ, описывающих эндоваскулярный метод стентирования выходного отдела правого желудочка (ВОПЖ) как альтернативу формированию модифицированного шунта Блэлок-Тауссиг [3-7].
Целью нашего исследования является сравнительная оценка развития легочного русла после двух методов паллиативной помощи (стентирования выходного отдела правого желудочка или формирования модифицированного шунта Блэлок-Тауссиг) и результатов двухэтапной коррекции у младенцев с критической формой тетрады Фалло.
Материалы и методы
В период с 2019 по 2022 год на базе ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» совместно с ГБУЗ «Морозовская ДГКБ ДЗМ» проведено проспективное рандомизированное двуцентровое исследование. Расчет размера выборки выполнен с помощью приложения G*Power 3.1 (http://gpower.hhu.de). Принимая результаты ретроспективных исследований Dohlen G. и соавторов [5], Zhou T. и соавторов [26], было рассчитано, что 21 пациента в каждой из двух групп будет достаточно для воспроизведения разницы по индексу Nakata к этапу радикальной коррекции после паллиативного вмешательства. Мощность исследования 80%. В соответствии с критериями включения и не включения (рис. 1) из 47 пациентов в исследование набрано 42 младенца, которым выполнена этапная коррекция порока. После рандомизации путем случайных цифр дети были разделены на две группы (по 21 пациенту в каждой группе) в зависимости от метода паллиативного лечения (стентирование ВОПЖ либо формирование мБТШ). Дизайн исследования представлен на рисунке 2.
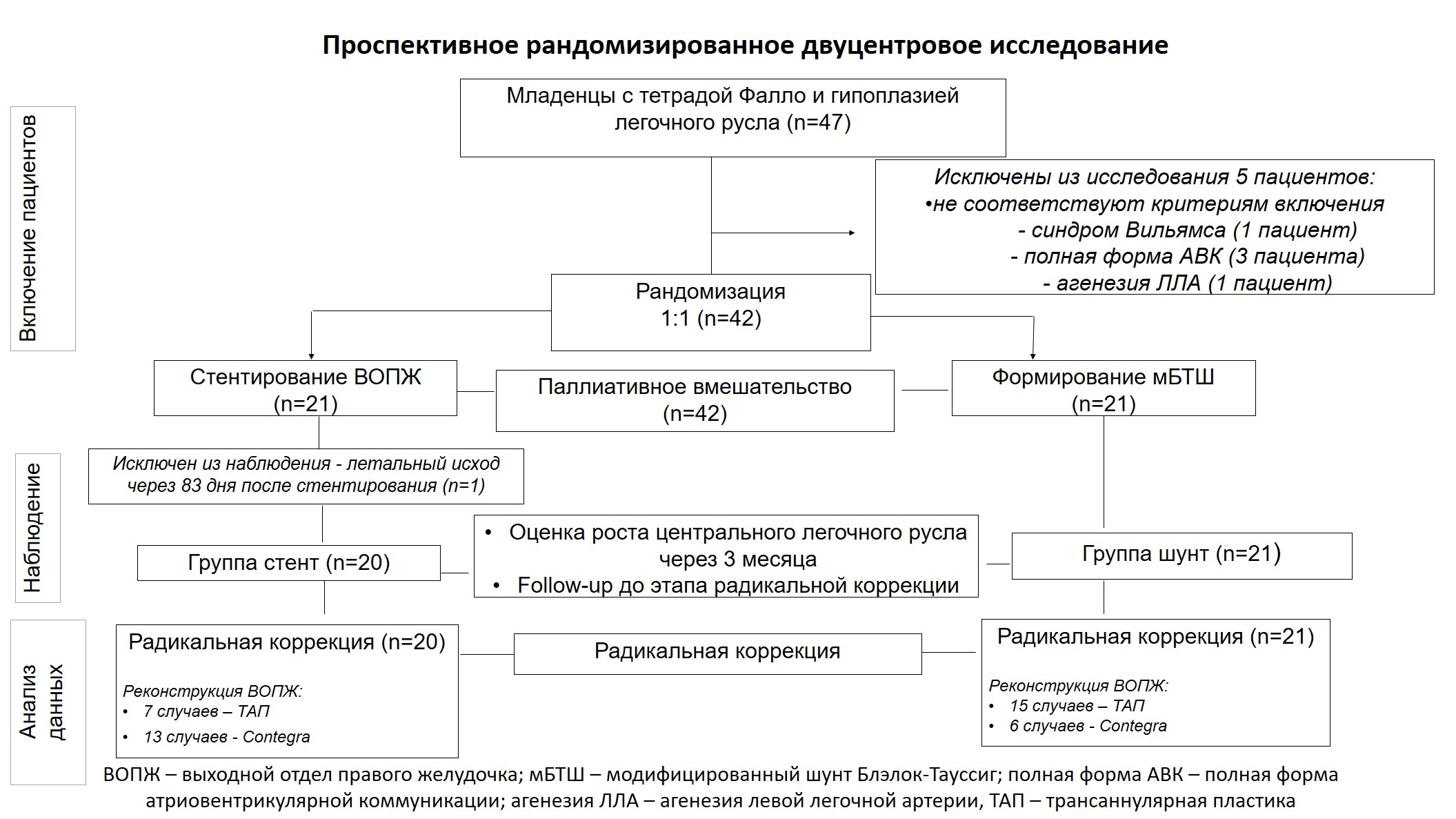
Рисунок 1. Критерии включения и не включения в исследование
Figure 1. Inclusion and exclusion criteria for the study

Рисунок 2. Дизайн исследования.
Figure. 2. Study design
Примечание/Note: ВОПЖ – выходной отдел правого желудочка (RVOT – right ventricular outflow tract); мБТШ – модифицированный шунт Блэлок-Тауссиг (mBTS – modified Blalock-Taussig shunt); ТАП – трансаннулярная пластика (TAP – transannular patch)
Данная работа посвящена сравнительной оценке степени развития центрального легочного русла после паллиативного вмешательства, описанию осложнений в межэтапном периоде и результатам отсроченной анатомической коррекции.
Первичной конечной точкой являлась: степень развития центрального легочного русла через 3 месяца после паллиативной операции. Эффект от паллиативного лечения считался достигнутым при индексе Nakata ≥200 мм2/м2 (результат оценивался с помощью бинарной логистической регрессии).
Вторичные конечные точки:
- сравнительная оценка роста центрального легочного русла к моменту отсроченной анатомической коррекции (результаты проанализированы с помощью смешанной модели);
- частота реинтервенций и летальность в межэтапном периоде;
- сравнительная оценка результатов отсроченной анатомической коррекции;
- вариант реконструкции выходного отдела правого желудочка при отсроченной радикальной коррекции (трансаннулярная пластика, имплантация клапансодержащего ксенокондуита легочной артерии).
Динамика роста клапана, ствола легочной артерии, правой и левой ветвей легочной артерии на уровне бифуркации оценивалась с помощью серии эхокардиографических исследований, выполненных до паллиативного лечения, амбулаторно в межэтапном периоде, к моменту отсроченной анатомической коррекции. Результаты проанализированы индексированными показателями z score [19]. Для уточнения анатомии выходного отдела правого желудочка, степени гипоплазии легочного русла, анатомии коронарных артерий до паллиативного вмешательства и спустя 3 месяца проводилась мультиспиральная компьютерная томография (МСКТ) с контрастированием. Степень гипоплазии легочного русла оценивалась с помощью индекса Nakata [17,18].
Хирургическая техника
Стентирование выходного отдела правого желудочка
Процедура ангиопульмонографии с вентрикулографией правого желудочка, стентирование выходного отдела правого желудочка осуществлялись в интервенционной операционной в условиях интубационного наркоза с искусственной вентиляцией легких и миорелаксацией. Выбор диаметра стента определялся из расчета диаметра наиболее узкого места пути оттока в легочную артерию в фазу диастолы плюс 1–2 мм. Стент устанавливался на всем протяжении выходного отдела правого желудочка. В случае выраженного комбинированного стеноза стент пересекал клапан легочной артерии.
Радикальная коррекция
Во всех случаях операция выполнялась в условиях искусственного кровообращения, умеренной гипотермии, с применением кардиоплегического раствора Кустадиол. Выбор метода реконструкции выходного отдела правого желудочка был обусловлен оценкой риска развития правожелудочковой недостаточности.
Результаты
Реабилитация легочного русла
Проведена сравнительная оценка динамики роста центрального легочного русла от момента паллиативной помощи до отсроченной анатомической коррекции с помощью индексированных показателей. При межгрупповом сравнении степень развития центрального легочного русла в группах стент и шунт до паллиативного лечения не отличалась.
К моменту радикальной коррекции роста клапана легочной артерии в исследуемых группах не выявлено (p=0,5 в группе стент, p=0,1 в группе шунт). Однако отмечается развитие ветвей легочной артерии. За период наблюдения медиана z score правой легочной артерии в группе стент увеличилась с −2,3 до 0,08 (p<0,01); в группе шунт – с −2,3 до −1,5 (p<0,01) соответственно. Медиана z score левой легочной артерии в группе стент выросла с −2,1 до 0,5 (p<0,01); в группе шунт с −1,9 до −0,25 (p<0,01). На рисунке 3 представлены все измерения ветвей легочных артерий по данным эхокардиографии. Также динамика роста легочных артерий по z score за период наблюдения представлена в таблице 1 и рисунке 4. По данным МСКТ с контрастированием через 3 месяца после паллиативного лечения также отмечен рост легочного русла по индексу Nakata в среднем с 104,2 мм2/м2 до 208,6 мм2/м2 в группе стент (p<0,01) и с 107,3 мм2/м2 до 169,4 мм2/м2 в группе шунт (p<0,01). К этапу радикальной коррекции при межгрупповом сравнении показатели z score правой и левой легочных артерий, индекса Nakata в группе стент достоверно выше, чем в группе шунт (p<0,01; p=0,049 и p<0,01 соответственно). Результаты межгруппового сравнения индексированных показателей z score перед радикальной коррекцией и прирост z score за период наблюдения представлены в таблице 2.
Характеристика | Показатели перед РК | P value | Характеристика | группа шунт | P value | ||
группа стент (n=20) | группа шунт (n=21) | группа стент (n=20) | группа шунт (n=21) | ||||
z score клЛА | −3,2 (−4,1;−2,6) | −3,1 (−4,5;−2,4) | 0,7 | ∆z score клапана ЛА | 0,35 (−0,34;1,1) | 0.48 (-0.67;2.19) | 0.6 |
z score стЛА | −1,6 (−2,4;−0,8) | −2,6 (−3,7;−1,9) | 0,02 | ∆z score ствол ЛА | 2,03 (0,49;2,77) | 1.59 (0.4;2.32) | 0.3 |
z score ПЛА | 0,08 (−0,4;0,9) | −1,5 (−2,1;−0,6) | <0,01 | ∆z score ПЛА | 2,2 (1,7;3,5) | 1.1 (0.8;1.97) | <0,01 |
z score ЛЛА | 0,5 (−0,4;1,7) | −0,3 (−0,5;0,5) | 0,049 | ∆z score ЛЛА | 2,6 (1,7;3,6) | 1.6 (1.1;2.4) | 0.02 |
Индекс Nakata | 208,6 (173;266) | 169,4 (139,7;187,1) | <0,01 | ∆Индекс Nakata | 105,2 (64,8;137,8) | 58.2 (50.3;83.6) | 0,01 |
Характеристика | группа стент | P value | группа шунт | P value | ||
до паллиатива (n=21) | к этапу РК (n=20) | до паллиатива (n=21) | к этапу РК (n=21) | |||
z score клЛА | −3,3 (−4,5;−2,8) | −3,2 (−4,1;−2,6) | 0,5 | −3,8 (−5,7;−2,7) | -3.1 (-4.5;-2.4) | 0.1 |
z score стЛА | −3,8 (−4,7;−2,8) | −1,6 (−2,4;−0,8) | <0,01 | −3,9 (−4,3;−3,5) | -2.6 (-3.7;-1.9) | 0,01 |
z score ПЛА | −2,3 (−2,8;−1,7) | 0,08 (−0,4;0,9) | <0,01 | −2,3 (−3;−1,9) | -1.5 (-2.1;-0.6) | <0,01 |
z score ЛЛА | −2,1 (−2,4;−1,3) | 0,5 (−0,4;1,7) | <0,01 | −1,9 (−2,5;−1,7) | -0.25 (-0.53;0.47) | <0,01 |
Индекс Nakata | 104,2 (81,5;122,3) | 208,6 (173;266) | <0,01 | 107,3 (85,1;115,1) | 169.4 (139.7;187.1) | <0,01 |
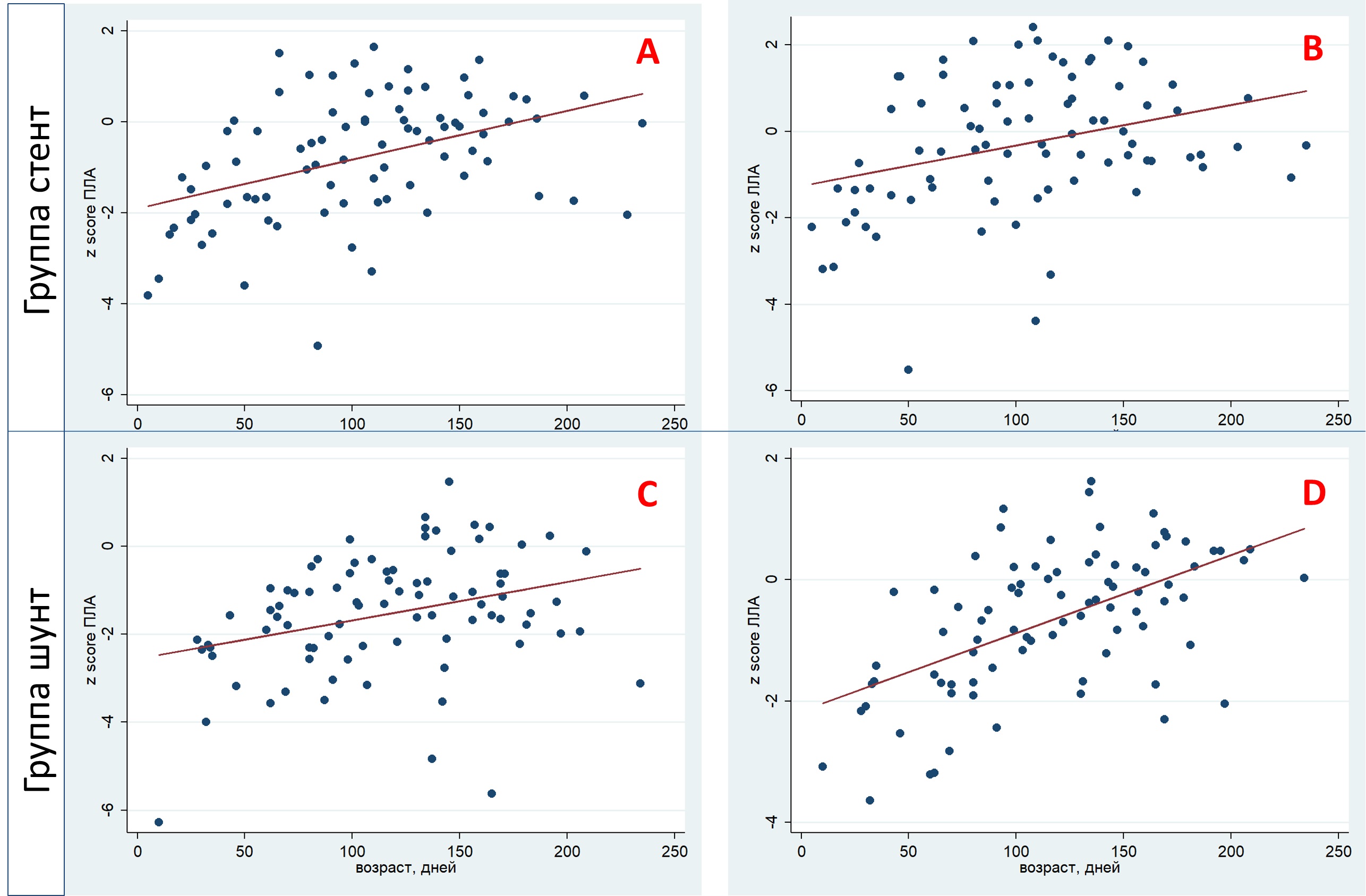
Рисунок 3. Развитие ветвей легочной артерии (по z score) за период наблюдения в группах стент и шунт. A, B – развитие ветвей легочной артерии в группе стент; C, D – развитие ветвей легочной артерии в группе шунт. Красной линией отмечена линия предикции развития легочной артерии
Figure 3. Development of pulmonary artery branches (according to z score) during the observation period in the stent and shunt groups. A, B – development of pulmonary artery branches in the stent group; C, D – development of pulmonary artery branches in the shunt group. The red line marks the line for predicting the development of the pulmonary artery
Примечание/Note: КлЛА – клапан легочной артерии (PV – pulmonary valve); ПЛА – правая легочная артерия (RPA – right pulmonary artery); ЛЛА – левая легочная артерия (LPA – left pulmonary artery); РК – радикальная коррекция (CR – complete repair).
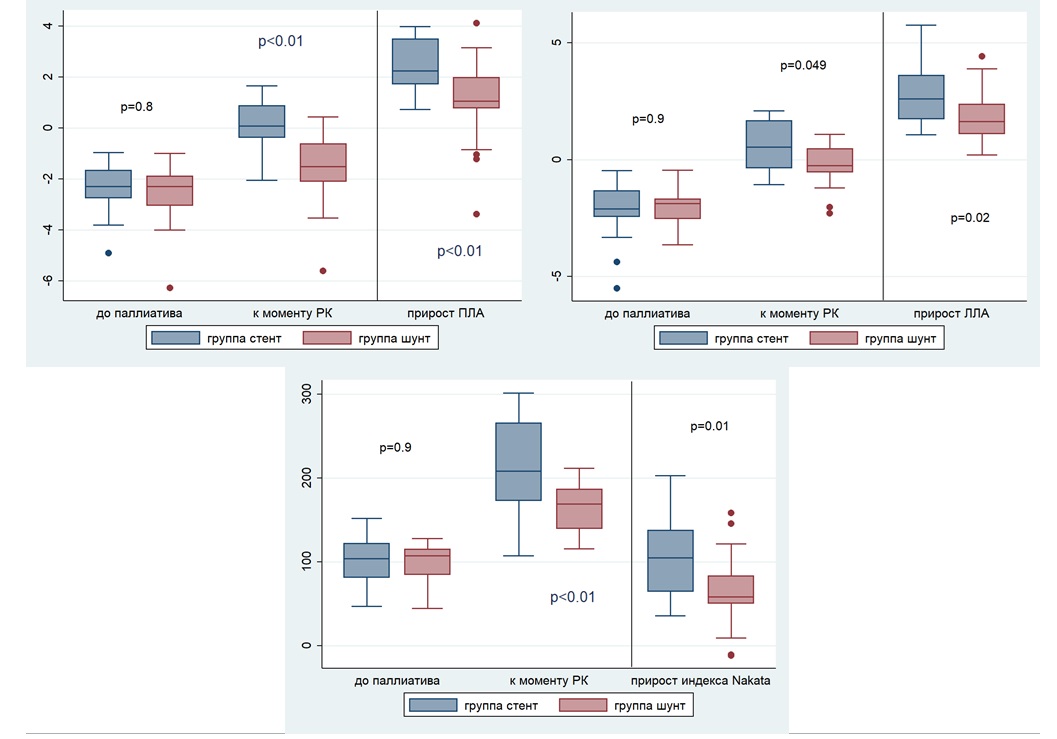
Рисунок 4. Межгрупповое сравнение развития ветвей легочной артерии от момента паллиативного лечения до радикальной коррекции
Figure. 4. Between-group comparison of pulmonary arterial growth from palliative procedures to complete repair
Примечание/Note: КлЛА – клапан легочной артерии (PV – pulmonary valve); ПЛА – правая легочная артерия (RPA – right pulmonary artery); ЛЛА – левая легочная артерия (LPA – left pulmonary artery); РК – радикальная коррекция (CR – complete repair).
Прирост клЛА (∆z score) = z score клЛА перед РК − z score клЛА до паллиатива (PV growth (∆z score) = z scorePV before CR − z score PV before palliative procedures).
С помощью соотношения диаметров ПЛА/ЛЛА установлено, что после стентирования выходного отдела отмечается тенденция к более равномерному развитию ветвей легочной артерии, чем после формирования модифицированного шунта Блэлок-Тауссиг (рис. 5).
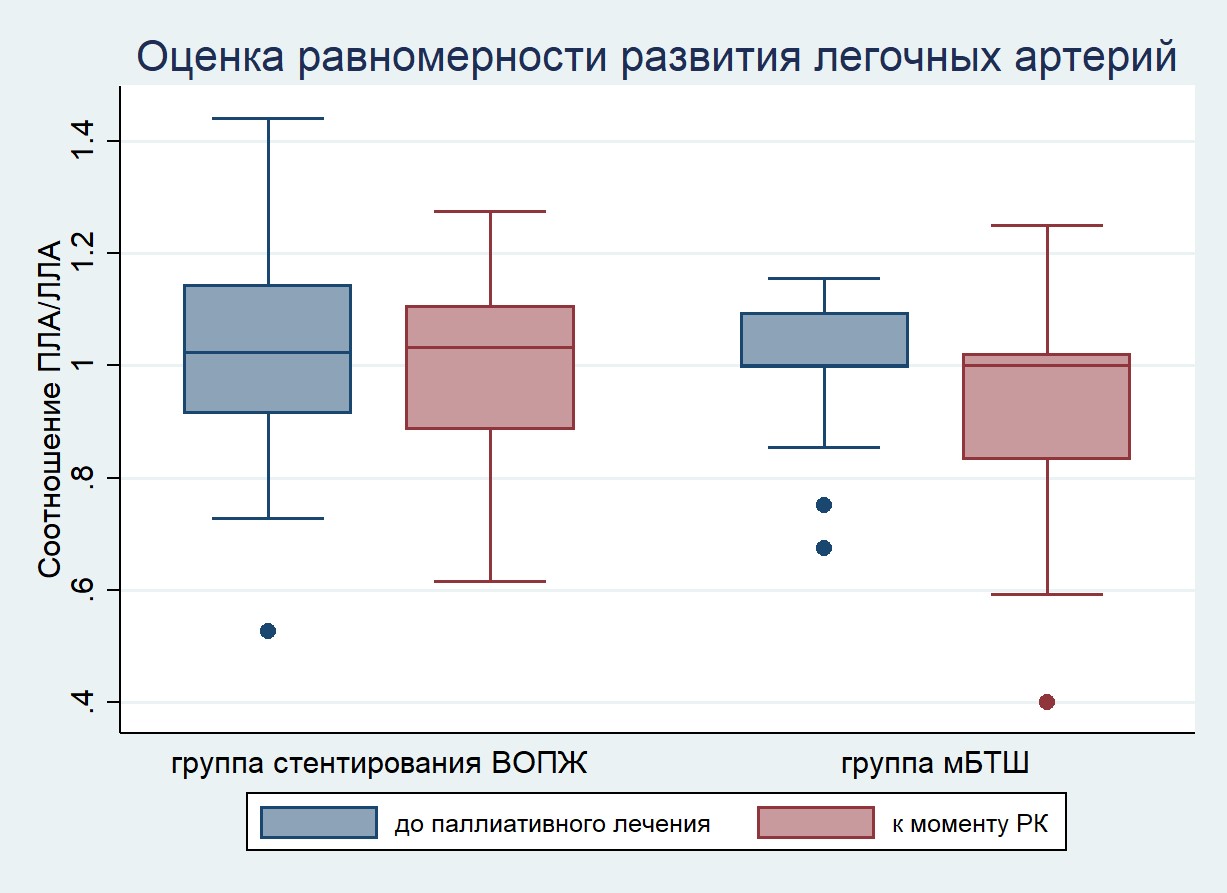
Рисунок 5. Равномерность развития ветвей легочных артерий (соотношение ПЛА/ЛЛА) от момента паллиативной помощи до радикальной коррекции
Figure 5. Uniform of growth of the branch pulmonary arteries (RPA/LPA ratio) from palliative procedures to complete repair.
Примечание/Note: РК – радикальная коррекция (CR – complete repair).
Для сравнительной оценки скорости роста центрального легочного русла в исследуемых группах выполнен анализ смешанной модели (табл. 3). В результате которой выявлено, что стентирование ВОПЖ приводит к росту правой легочной артерии со скоростью 2,05*10-2 z score/день, что в 3,01 раз превышает показатель в 0,68*10-2 z score/день группы шунт. Скорость роста левой легочной артерии в группе стент 2,23*10-2 z score/день, что в 1,47 раз больше, чем в группе шунт с показателем 1,56*10-2 z score/день. Ни один из независимых предикторов (недоношенность, новорожденность, вес перед паллиативным лечением) достоверно не повлияли на скорость роста легочных артерий.
| Ствол ЛА | p | ПЛА | p | ЛЛА | p |
Группа стент (z score/день) | 2,15*10−2 | <0,01 | 2,05*10−2 | <0,01 | 2,3*10−2 | <0,01 |
Группа шунт (z score/день) | 1,23*10−2 | <0,01 | 0,68*10−2 | 0,02 | 1,56*10−2 | <0,01 |
Отношение скорости роста легочной артерии группы стент/группы шунт | 1,75 | 3,01 | 1,47 | |||
Недоношенность | −0,337 | 0,49 | 0,17 | 0,68 | 0,22 | 0,5 |
Новорожденность | 0,046 | 0,9 | −0,27 | 0,5 | −0,16 | 0,6 |
Примечание/Note: ЛА – легочная артерия (PA – pulmonary artery); ПЛА – правая легочная артерия (RPA – right pulmonary artery); ЛЛА – левая легочная артерия (LPA – left pulmonary artery)
С целью определения факторов, влияющих на достижение индекса Nakata ≥200 мм2/м2 в исследуемых группах выполнена бинарная логистическая регрессия, в результате которой получено, что стентирование выходного отдела правого желудочка увеличивает шанс достижения индекса Nakata ≥200 мм2/м2 в 7,78 раз чаще, в сравнении с формированием модифицированного шунта Блэлок-Тауссиг. Результаты представлены в таблице 4.
Переменная | Однофакторный анализ | Многофакторный анализ | ||
ОШ (95% ДИ) | p-значение | ОШ (95% ДИ) | p-значение | |
Возраст | 0,986 (0,964; 1,007) | 0,212 | 1,017 (0,983; 1,059) | 0,354 |
Недоношенность | 0,846 (0,107; 4,987) | 0,858 | 0,200 (0,007; 3,066) | 0,288 |
Группа | 9,000 (2,180; 48,321) | 0,004 | 7,777 (1,612; 49,924) | 0,016 |
Длительность межэтапного периода | 0,999 (0,991; 1,004) | 0,641 | 0,998 (0,990; 1,003) | 0,429 |
Межэтапный период
У одного пациента (4,8%) спустя 76 дней после стентирования выходного отдела правого желудочка зафиксировано тяжелое течение инфекционного процесса с развитием сепсиса, послужившим причиной летального исхода. В остальных случаях осложнений, приведших к госпитализации в межэтапном периоде, повторных реинтервенций не выявлено.
Радикальная коррекция
Отсроченная анатомическая коррекция выполнена у 20 пациентов группы стент в среднем спустя 97 (92;118) дней после паллиативного вмешательства и у 21 младенцев группы шунт спустя 109 (106;128) дней соответственно. Общие характеристики пациентов перед оперативным лечением представлены в таблице 5.
Характеристики | Группа стент | Группа шунт | p |
Возраст, дней | 151(136;192,5) | 182(166;200) | 0,08 |
Вес, кг | 6,1(5,67;6,91) | 6,2(5,7;6,6) | 0,98 |
SatO2, % | 89,5(86;93) | 83(78;85) | <0,01 |
ФВ ЛЖ, % | 77(68,5;78,5) | 71(68;73) | 0,13 |
ФИП ПЖ, % | 45(42;50) | 45(43;50) | 0,7 |
Диаметр ВОПЖ, мм | 4,9(4,2;5) | 3,2(3;4) | <0,01 |
Пиковый градиент давления ВОПЖ, мм рт. ст. | 70(55;75) | 100(85;110) | <0,01 |
Пиковый градиент клЛА, мм рт. ст. | 80(67;92,5) | 106(95;116) | <0,01 |
Примечание/Note: ВОПЖ – выходной отдел правого желудочка (RVOT – right ventricular outflow tract); клЛА – клапан легочной артерии (PV – pulmonary valve); ФВ ЛЖ – фракция выброса левого желудочка (LVEF – left ventricular ejection fraction); ФИП ПЖ – фракция выброса правого желудочка (RVEF – right ventricular ejection fraction)
Характеристики | Группа стент | Группа мБТШ | p |
Окклюзия аорты, часов | 71 (64;85) | 41 (30;48) | <0,01 |
Длительность искусственного кровообращения, часов | 104 (96;130,5) | 77 (63;85) | <0,01 |
Длительность операции, часов | 241 (180;290) | 315 (270;360) | 0,046 |
Длительность инотропной поддержки, часов | 38 (10;60) | 36 (24;72) | 0,4 |
Длительность ИВЛ, часов | 15,5 (4;43) | 24(24;36) | 0,04 |
Длительность лечения в ОРИТ, дней | 3 (2;5) | 2 (2;3) | 0,08 |
ФВ ЛЖ, % | 70,5 (61;75) | 68 (65;73) | 0,8 |
ФИП ПЖ, % | 48(45,5;50) | 45(42;50) | 0,2 |
Градиент давления ВОПЖ/ЛА, мм рт. ст. | 16 (9;24) | 16 (11;19) | 0,8 |
Осложнения, n (%) | 2 (10%) | 3 (14%) | 0,9 |
Длительность госпитализации, дней | 15 (12;20) | 16 (15;22) | 0,2 |
Примечание/Note: ИВЛ – искусственная вентиляция легких (ALV – artificial lung ventilation); ОРИТ – отделение реанимации (ICU – intensive care unit); ВОПЖ – выходной отдел правого желудочка (RVOT – right ventricular outflow tract); ЛА – легочная артерия (PA – pulmonary artery); ПЛА – правая легочная артерия (RPA – right pulmonary artery); ЛЛА – левая легочная артерия (LPA – left pulmonary artery)
У пациентов 1-ой группы стент располагался на всем протяжении выходного отдела правого желудочка с врастанием структур голометаллического стента в гипертрофированные септо-париетальные трабекулы ВОПЖ. У 12 из 20 детей (55%) стент пересекал клапан легочной артерии, в оставшихся 9 (45%) случаях располагался изолированно в выходном отделе правого желудочка.
В обеих группах после паллиативного лечения сохранялась гипоплазия клапана легочной артерии с медианой z score −3,2 в группе стент и медианой z score −3,1 в группе шунт; створки клапана в большинстве случаев были представлены фиброзно измененными валиками. В связи с сохраняющейся выраженной гипоплазией, нативный клапан при радикальной коррекции во всех случаях был пересечен. Интраоперационно при ревизии, ранее имплантированные стенты не были деформированы, проходимы, покрыты фиброзной тканью по периметру. В процессе эксплантации стент постепенно иссекался из выходного отдела правого желудочка и извлекался из ствола легочной артерии без значимых технических проблем. В случае трансаннулярного расположения, одномоментно резецировались фиброзированные створки клапана легочной артерии. У 12 (60%) из 20 пациентов группы стент и 15 (71,4%) из 21 детей группы шунт выполнена трансаннулярная пластика выходного отдела правого желудочка (p=0,52). У 8 детей (40%) группы стент и у 6 (28,6%) в группе шунт выполнено протезирование пути оттока в легочную артерию клапансодержащим ксенокондуитом Contegra №12 (Medtronic, USA) (p=0,52). В связи с деформацией и стенозом легочной артерии в области ранее сформированого шунта, реконструкция пути оттока в легочную артерию дополнялась пластикой стенозированной ветви.
В группе шунт длительность операции была достоверно дольше (p=0,046), в сравнении с группой стент, что обусловлено спаечным процессом в полости перикарда (табл. 6). Однако учитывая дополнительную трату времени на эксплантацию стента из выходного отдела правого желудочка – длительность окклюзии аорты, искусственного кровообращения в группе стент достоверно больше (p<0,01 и p<0,01 соответственно). В связи с развитием выраженной правожелудочковой недостаточности в раннем послеоперационном периоде у одного пациента группы стент (5%) и еще одного – группы шунт (4,8%) после трансаннулярной пластики, потребовалась установка экстракорпоральной мембранной оксигенации (в течение 10 дней пациенту группы стент и в течение 5 дней – в группе шунт) с дальнейшим благоприятным исходом. Также в исследуемых группах зарегистрировано по одному случаю стентирования ветвей легочных артерий после протезирования легочной артерии. В группе шунт в одном случае (4,8%) потребовалась пликация левого купола диафрагмы на 8-е сутки после операции. За период стационарного лечения летальных исходов не выявлено (p>0,99).
Обсуждение
Стентирование выходного отдела правого желудочка является потенциально достойной альтернативой формированию модифицированного шунта Блэлок-Тауссиг, обладая такими преимуществами как: антеградный пульсирующий ток венозной крови в легочное русло с большим насыщением артериальной крови кислородом; быстрая стабилизация гемодинамики и перфузии органов за счет отсутствия снижения диастолического артериального давления [2,4,21-24].
В рамках нашего проспективного двухцентрового рандомизированного исследования проведена сравнительная оценка результатов двух методов паллиативной помощи – стентирования выходного отдела правого желудочка и формирования модифицированного шунта Блэлок-Тауссиг. С изучением их влияния на развитие легочного русла, описанием крупных кардиоваскулярных событий в межэтапном периоде и оценкой непосредственных результатов радикальной коррекции.
Ряд исследований подтверждает, что стентирование выходного отдела правого желудочка при критической форме тетрады Фалло является эффективной и безопасной процедурой с летальностью 0% [Sandoval J. P. et al], 1,7% [Quandt D, et al] в раннем послеоперационном периоде. А результаты отсроченного хирургического лечения после стентирования ВОПЖ сопоставимы с данными первичной анатомической коррекции детей более старшей возрастной группы [25]. В нашем исследовании летальность в раннем послеоперационном периоде после паллиативного лечения также составила 0%. Отмечен лишь 1 летальный исход (4.8%) в межэтапном периоде у пациента группы стент, связанный с некардиальной патологией.
В остальном больших кардиоваскулярных событий в исследуемых группах в межэтапном периоде не выявлено. Однако в литературе описаны случаи сохраняющейся десатурации после стентирования ВОПЖ, обусловленной образующейся обструкцией в проксимальной части выводного тракта правого желудочка, деформирующей соответствующий участок стента. В подобных ситуациях проводилась баллонная ангиопластика либо установка еще одного стента с заходом на предыдущий [2,5-8,25]. Ряд авторов приводят случаи сохраняющейся десатурации после стентирования ВОПЖ, потребовавшие дополнительного формирования мБТШ [7,25]. В свою очередь после формирования мБТШ отмечены случаи тромбоза, требовавшие повторного формирования шунта либо стентирования пути оттока в легочную артерию [3,7,8].
При оценке влияния обоих методов паллиативного лечения на рост легочного русла в работе показано, что стентирование выходного отдела правого желудочка приводит к более быстрому, значимому и равномерному развитию легочного русла в сравнении с формированием модифицированного шунта Блэлок-Тауссиг (рис. 4, 5, табл. 1). За период наблюдения в группе стент прирост правой легочной артерии (∆z score) составил 2,2, что достоверно больше чем в группе шунт с показателем в 1,1. Аналогичная картина наблюдается с левой легочной артерией: в группе стент ∆z score 2,6, что достоверно превышает показатель группы шунт в 1,6. С помощью смешанной модели также установлено, что скорость роста правой и левой легочных артерий достоверно больше в группе стент (табл. 3). В ретроспективных исследованиях ряда авторов [Quandt и соавт.; McGovern и соавт.; Dohlen и соавт.; Stumper и соавт.] приведены аналогичные результаты, подтверждающие более быстрый и равномерный рост ветвей легочных артерий после стентирования пути оттока в легочную артерию. В работах группы авторов из Торонто описано, что у 80% пациентов на момент стентирования пути оттока в легочную артерию индекс Nakata был <100 мм2/м2, в то время как к этапу радикальной коррекции только у 16% детей индекс Nakata оставался меньше 100 мм2/м2 [25]. В исследовании Dohlen и соавт. описано увеличение индекса Nakata в среднем с 56 мм2/м2 (21–77) до 150 мм2/м2 (123–231) [5]. В нашем исследовании в группе стент прирост (∆) индекса Nakata составил 105,2 мм2/м2, что достоверно больше чем в группе шунт с показателем 58.2 мм2/м2. По результатам бинарной логистической регресии отмечено, что стентирование увеличивает шанс достижения индекса Nakata ≥200 мм2/м2 в 7,78 раз чаще, в сравнении с формированием модифицированного шунта Блэлок-Тауссиг.
Одним из немаловажных вопросов является реконструкция выходного отдела правого желудочка при отсроченной радикальной коррекции. Коллеги из Бирменгема в одноцентровом ретроспективном исследовании описывают, что тип реконструкции выходного отдела правого желудочка после стентирования ВОПЖ или формирования мБТШ был схожим [7]. В 58% случаев после стентирования ВОПЖ и 59% после формирования мБТШ выполнена трансаннулярная пластика выходного отдела правого желудочка. В 30% после стентирования и 31% после формирования шунта выполнено протезирование легочной артерии. Также отмечено, что число пластических вмешательств на ветвях легочных артерий после стентирования ВОПЖ меньше (15%), в сравнении с результатами после формирования мБТШ (31%).
По результатам нашего исследования тип реконструкции пути оттока в легочную артерию в исследуемых группах статистически не отличался. В 12 (60%) случаях из 20 в группе стент и 15 (71,4%) из 21 – в группе шунт выполнена трансаннулярная пластика выходного отдела правого желудочка. У 8 детей (40%) группы стент и у 6 (28,6%) в группе шунт выполнено протезирование пути оттока в легочную артерию. Выбор способа реконструкции был обусловлен оценкой риска развития правожелудочковой недостаточности. У всех пациентов группы шунт потребовалось дополнительное пластическое вмешательство на стенозированной после формирования мБТШ легочной артерии. В одном случае у пациента группы стент после протезирования легочной артерии выявлены устьевые стенозы ветвей легочной артерии, потребовавшие дополнительного стентирования. При межгрупповом сравнении длительность операции радикальной коррекции в группе стент была достоверно короче. В то время как длительность окклюзии аорты и искусственного кровообращения достоверно выше в группе стентирования ВОПЖ, что можно объяснить дополнительным временем, необходимым для эксплантации стента из выходного отдела правого желудочка.
Ограничения исследования
Учитывая слишком малый процент детей с тяжелой формой тетрады Фалло, размер выборки в рамках проспективного рандомизированного исследования ограничен 21 пациентами в каждой группе. Что может быть не достаточным для определения наличия или отсутствия разницы в некоторых исследуемых параметрах и ограничивать значимость полученных результатов.
Заключение
Стентирование выходного отдела правого желудочка является безопасной процедурой, обеспечивающей более быстрое, значимое и равномерное развитие легочного русла в сравнении с формированием модифицированного шунта Блэлок-Тауссиг.
Список литературы
1. Al Habib HF, Jacobs JP, Mavroudis C, Tchervenkov CI, O’Brien SM, Mohammadi S, Jacobs ML. Contemporary patterns of management of tetralogy of Fallot: data from the Society of Thoracic Surgeons Database. Ann Thorac Surg. 2010 Sep;90(3):813–820. https://doi.org/10.1016/j.athoracsur.2010.03.110
2. Barron DJ. Tetralogy of Fallot: controversies in early management. World J Pediatr Congenit Heart Surg. 2013 Apr;4(2):186–191. https://doi.org/10.1177/2150135112471352
3. Petrucci O, O’Brien SM, Jacobs ML, Jacobs JP, Manning PB, Eghtesady P. Risk factors for mortality and morbidity after the neonatal BlalockTaussig shunt procedure. Ann Thorac Surg. 2011 Aug;92(2):642–652. https://doi.org/10.1016/j.athoracsur.2011.02.030
4. Quandt D, Ramchandani B, Stickley J, Mehta C, Bhole V, Barron DJ, Stumper O. Stenting of the Right Ventricular Outflow Tract Promotes Better Pulmonary Arterial Growth Compared With Modified BlalockTaussig Shunt Palliation in Tetralogy of Fallot-Type Lesions. JACC Cardiovasc Interv. 2017 Sep 11;10(17):1774–1784. https://doi.org/10.1016/j.jcin.2017.06.023
5. Dohlen G, Chaturvedi RR, Benson LN, Ozawa A, Van Arsdell GS, Fruitman DS, Lee KJ. Stenting of the right ventricular outflow tract in the symptomatic infant with tetralogy of Fallot. Heart. 2009 Feb;95(2):142–147. https://doi.org/10.1136/hrt.2007.135723
6. Stumper O, Ramchandani B, Noonan P, Mehta C, Bhole V, Reinhardt Z, Dhillon R, Miller PA, de Giovanni JV. Stenting of the right ventricular outflow tract. Heart. 2013 Nov;99(21):1603–1608. https://doi.org/10.1136/heartjnl-2013-304155
7. Quandt D, Ramchandani B, Penford G, Stickley J, Bhole V, Mehta C, Jones T, Barron DJ, Stumper O. Right ventricular outflow tract stent versus BT shunt palliation in Tetralogy of Fallot. Heart. 2017 Dec;103(24):1985-1991. https://doi.org/10.1136/heartjnl-2016-310620
8. Barron DJ, Jegatheeswaran A. How and When Should Tetralogy of Fallot be Palliated Prior to Complete Repair? Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2021;24:77-84. https://doi.org/10.1053/j.pcsu.2021.02.002
9. François Godart; Shakeel A Qureshi; Ary Simha; Philip B Deverall; David R Anderson; Edward J Baker; Michael Tynan (1998). Effects of modified and classic Blalock-Taussig shunts on the pulmonary arterial tree. Ann Thorac Surg. 1998 Aug;66(2):512-7; discussion 518. https://doi.org/10.1016/s0003-4975(98)00461-5
10. Joseph Caspi; Timothy W. Pettitt; Theodorus Mulder; Aluizio Stopa. Development of the Pulmonary Arteries After the Norwood Procedure: Comparison Between Blalock-Taussig Shunt and Right Ventricular– Pulmonary Artery Conduit. Ann Thorac Surg. 2008 Oct;86(4):0–1304. https://doi.org/10.1016/j.athoracsur.2008.06.016
11. Rumball, Elizabeth M., McGuirk, Simon P., Stümper, Oliver, Laker, Simon J., de Giovanni, Joseph V., Wright, John G., Barron, David J., Brawn, William J. The RV–PA conduit stimulates better growth of the pulmonary arteries in hypoplastic left heart syndrome. European Journal of Cardio-Thoracic Surgery. Eur J Cardiothorac Surg. 2005 May;27(5):801–806. https://doi.org/10.1016/j.ejcts.2005.01.061
12. Jay D. Pruetz; Sarah Badran; Fred Dorey; Vaughn A. Starnes; Alan B. Lewis. Differential branch pulmonary artery growth after the Norwood procedure with right ventricle–pulmonary artery conduit versus modified Blalock–Taussig shunt in hypoplastic left heart syndrome. J Thorac Cardiovasc Surg. 2009 Jun;137(6):1342–1348. https://doi.org/10.1016/j.jtcvs.2009.03.019
13. Andrew C. Fiore; Courtney Tobin; Saadeh Jureidini; Mohammad Rahimi; Eric S. Kim; Kenneth Schowengerdt. A Comparison of the Modified Blalock-Taussig Shunt With the Right Ventricle-to-Pulmonary Artery Conduit. Ann Thorac Surg. 2011 May;91(5):1479–1485. https://doi.org/10.1016/j.athoracsur.2010.11.062
14. Jo T. K. et al. Outcome of neonatal palliative procedure for pulmonary atresia with ventricular septal defect or tetralogy of Fallot with severe pulmonary stenosis: experience in a single tertiary center. Korean J Pediatr. 2018 Jul;61(7):210-216. https://doi.org/10.3345/kjp.2018.61.7.210
15. Zheng S., Yang K., Li K., Li S. Establishment of right ventriclepulmonary artery continuity as the first-stage palliation in older infants with pulmonary atresia with ventricular septal defect may be preferable to use of an arterial shunt. Interact Cardiovasc Thorac Surg. 2014 Jul;19(1):88–94. https://doi.org/10.1093/icvts/ivu052
16. Lenoir M. et al. Outcomes of palliative right ventricle to pulmonary artery connection for pulmonary atresia with ventricular septal defect. European Journal of Cardio-Thoracic Surgery. 2017;52(3):590-598. https://doi.org/10.1093/ejcts/ezx194
17. Di Donato, Roberto M.; Jonas, Richard A.; Lang, Peter; Rome, Jonathan J.; Mayer, John E.; Castaneda, Aldo R. Neonatal repair of tetralogy of Fallot with and without pulmonary atresia. The Journal of Thoracic and Cardiovascular Surgery. 1991; 101(1):126–137. https://doi.org/10.1016/s0022-5223(19)36802-3
18. Audrey C Marshall; Barry A Love; Peter Lang; Richard A Jonas; Pedro J del Nido; John E Mayer; James E Lock. Staged repair of tetralogy of Fallot and diminutive pulmonary arteries with a fenestrated ventricular septal defect patch. J Thorac Cardiovasc Surg. 2003 Nov;126(5):1427–1433. https://doi.org/10.1016/s0022-5223(03)01182-6
19. Chubb, Henry; Simpson, John M. The use of Z-scores in paediatric cardiology. Annals of Pediatric Cardiology. 2012;5(2):179–84. https://doi.org/10.4103/0974-2069.99622
20. Pettersen, Michael D.; Du, Wei; Skeens, Mary Ellen; Humes, Richard A. Regression Equations for Calculation of Z Scores of Cardiac Structures in a Large Cohort of Healthy Infants, Children, and Adolescents: An Echocardiographic Study. Journal of the American Society of Echocardiography. 2008 Aug;21(8):922-934.. https://doi.org/10.1016/j.echo.2008.02.006
21. Dryzek P, Mazurek-Kula A, Moszura T, Sysa A. Right ventricle outflow tract stenting as a method of palliative treatment of severe tetralogy of Fallot. Cardiol J. 2008;15(4):376-9. PMID: 18698548
22. Cools, Bjorn; Boshoff, Derize; Heying, Ruth; Rega, Filip; Meyns, Bart; Gewillig, Marc. Transventricular balloon dilation and stenting of the RVOT in small infants with tetralogy of fallot with pulmonary atresia. Catheterization and Cardiovascular Interventions. 2013 Aug 1;82(2):260–265. https://doi.org/10.1002/ccd.24548
23. Niall Linnane, Mohamed Al Nasef, Colin J. McMahon, Jonathan McGuinness, Brian McCrossan, Paul Oslizlok, Kevin P. Walsh, Damien Kenny. Right ventricular outflow tract stenting in symptomatic infants without the use of a long delivery sheath. Catheterization and Cardiovascular Interventions. 2021;98(2):275-281. https://doi.org/10.1002/ccd.29708
24. Nokhrin, Andrey V.; Tarasov, Roman S.; Mukhamadiyarov, Rinat A.; Shishkova, Daria K.; Kutikhin, Anton G.; Dzyuman, Anna N.; Khlusov, Igor A.; Barbarash, Leonid S. Two‐stage approach for surgical treatment of tetralogy of Fallot in underweight children: Clinical and morphological outcomes. Journal of Cardiac Surgery. 2019;34(5):293-299. https://doi.org/10.1111/jocs.14031
25. Sandoval, Juan Pablo; Chaturvedi, Rajiv R.; Benson, Lee; Morgan, Gareth; Van Arsdell, Glen; Honjo, Osami; Caldarone, Christopher; Lee, Kyong-Jin. Right Ventricular Outflow Tract Stenting in Tetralogy of Fallot Infants With Risk Factors for Early Primary Repair. Circulation: Cardiovascular Interventions. 2016 Dec;9(12):e003979. https://doi.org/10.1161/circinterventions.116.003979
26. Zhou Tingwen; Wang Yixuan; Liu Junwei; Wang Yin; Wang Yongjun; Chen Si; Zhou Cheng; Dong Nianguo. Pulmonary artery growth after Modified Blalock-Taussig shunt: A single center experience. Asian Journal of Surgery, 2020;43(2):428-437. https://doi.org/10.1016/j.asjsur.2019.06.002
Об авторах
М. Г. МорсинаРоссия
Морсина Мелине Гамлетовна, врач сердечно-сосудистый хирург кардиохирургического отделения №1
ул. Речкуновская, д. 15, г. Новосибирск 630055
И. А. Сойнов
Россия
Сойнов Илья Александрович, к.м.н., врач сердечно-сосудистый хирург кардиохирургического отделения №1, старший научный сотрудник центра новых хирургических технологий
ул. Речкуновская, д. 15, г. Новосибирск 630055
А. В. Войтов
Россия
Войтов Алексей Викторович, к.м.н., врач сердечно-сосудистый хирург кардиохирургического отделения №1
ул. Речкуновская, д. 15, г. Новосибирск 630055
М. Г. Пурсанов
Россия
Пурсанов Манолис Георгиевич, д.м.н., врач рентгенэндоваскулярный хирург
4-й Добрынинский переулок, д. 1/9, Г. Москва 119049
Ю. Ю. Кулябин
Россия
Кулябин Юрий Юрьевич, к.м.н., врач сердечно-сосудистый хирург кардиохирургического отделения №1
ул. Речкуновская, д. 15, г. Новосибирск 630055
Н. Р. Ничай
Россия
Ничай Наталия Романовна, к.м.н., врач сердечно-сосудистый хирург кардиохирургического отделения врожденных пороков сердца
ул. Речкуновская, д. 15, г. Новосибирск 630055
Ул. Красный проспект, д. 52, Г. Новосибирск, 630091
А. В. Горбатых
Россия
Горбатых Артем Викторович, к.м.н., заведующий НИЛ интервенционной хирургии, врач по рентгенэндоваскулярной диагностике и лечению, врач сердечно-сосудистый хирург
Ул. Аккуратова, д. 2, Г. Санкт-Петербург, 197341
А. Н. Архипов
Россия
Архипов Алексей Николаевич, к.м.н., врач сердечно-сосудистый хирург, заведующий кардиохирургического отделения №1, старший научный сотрудник центра новых хирургических технологий
ул. Речкуновская, д. 15, г. Новосибирск 630055
А. В. Богачев-Прокофьев
Россия
Богачев-Прокофьев Александр Владимирович, д.м.н., директор института патологии кровообращения, врач сердечно-сосудистый хирург кардиохирургического отделения №3
ул. Речкуновская, д. 15, г. Новосибирск 630055
А. М. Чернявский
Россия
Чернявский Александр Михайлович, чл.-корр. РАН, д.м.н., профессор, директор
ул. Речкуновская, д. 15, г. Новосибирск 630055
Рецензия
Для цитирования:
Морсина М.Г., Сойнов И.А., Войтов А.В., Пурсанов М.Г., Кулябин Ю.Ю., Ничай Н.Р., Горбатых А.В., Архипов А.Н., Богачев-Прокофьев А.В., Чернявский А.М. Оценка развития легочного русла и результатов двухэтапной коррекции у младенцев с критической формой Тетрады Фалло. Евразийский Кардиологический Журнал. 2023;(4):6-15. https://doi.org/10.38109/2225-1685-2023-4-6-15
For citation:
Morsina M.G., Soynov I.A., Voitov A.V., Pursanov M.G., Kulyabin Yu.Yu., Nichay N.R., Gorbatykh A.V., Arkhipov A.N., Bogachev-Prokofiev A.V., Chernyavskiy A.M. Assessment of the pulmonary arterial growth and results of two-stage repair in infants with severe form of tetralogy of Fallot. Eurasian heart journal. 2023;(4):6-15. (In Russ.) https://doi.org/10.38109/2225-1685-2023-4-6-15































